Le rôle du cerveau dans le diabète est décrypté par une étude française
De récents travaux français d’une équipe Inserm révèlent le rôle crucial du cerveau dans le diabète de type 2 en décryptant le mécanisme de passage cérébral de l’hormone de la satiété, la leptine.
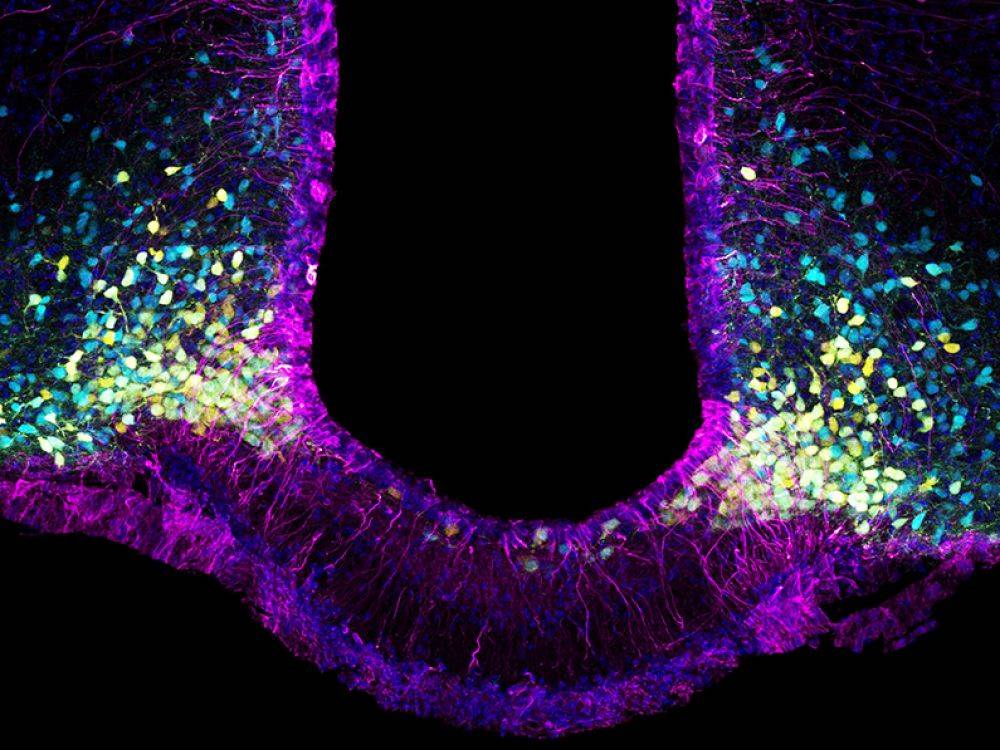
En violet, les tanycytes, la" porte" cellulaire du cerveau que la leptine doit franchir. En jaune, des neurones stimulant l’appétit et, en bleu, d'autres neurones d'action inverse supprimant l’appétit.
Ces deux types de neurones sont les cibles de la leptine ; les premiers vont être inhibés, les deuxièmes activés par le signal "coupe-faim" de cette hormone.
Le diabète est-il une maladie du système nerveux central ?
Des travaux français menés chez la souris récemment publiés dans la revue Nature Métabolisme soulèvent en tout cas la question en mettant en lumière le rôle clé que joue la leptine, l’hormone impliquée dans le contrôle de l’appétit.
Secrétée par le tissu adipeux, c’est en effet elle qui transmet au cerveau le fameux signal de satiété qui nous fait interrompre nos prises alimentaires.
Une équipe de chercheurs de l’Inserm, de l’université de Lille et du CHU de Lille au sein du laboratoire Lille Neuroscience et cognition, qui travaille depuis des années sur cette hormone,
est parvenue à mener chez la souris des travaux originaux qui décrivent avec précision le mécanisme de passage de la leptine vers le cerveau.
La leptine, appelée également hormone coupe-faim, est transportée par des cellules au cerveau
Les scientifiques savaient déjà que la leptine (dite aussi hormone coupe-faim) est transportée vers le cerveau par des cellules appelées tanycytes afin de délivrer aux neurones le message de satiété.
Ce transport s’effectue grâce à des récepteurs cellulaires dits LepR sur lesquels l’hormone se fixe,
et c'est tout particulièrement à eux que les chercheurs se sont intéressés pour étudier finement les mécanismes du transport de l'hormone.
Pour leurs travaux, ils ont utilisé des modèles particuliers de souris auxquels ils ont retiré le récepteur LepR situé à la surface des tanycytes.
Trois mois après cette manipulation, la masse grasse de ces animaux a été multipliée par deux à l’inverse de leur masse musculaire, diminuée elle de plus de la moitié, leur prise de poids totale n’ayant été au final que modérée.
Pendant toutes ces manipulations, les scientifiques ont aussi mesuré régulièrement le taux de sucre ( la glycémie ) des animaux, à jeun et après injection de glucose.
Ils ont constaté que pour maintenir une glycémie normale (soit entre 0,70 et 1,10 g/L), les souris devaient au cours du premier mois sécréter davantage d’insuline, l’hormone hypoglycémiante naturellement sécrétée par le pancréas. Trois mois après le retrait du récepteur, la capacité de sécrétion d’insuline par le pancréas des rongeurs semblait épuisée.
Un transport altéré de la leptine vers le cerveau est impliqué dans le développement du diabète de type 2
Le fait de retirer les récepteurs LepR et d’altérer le transport de la leptine vers le cerveau a donc conduit les rongeurs à développer
dans un premier temps, un état dit prédiabétique, qui survient lorsque l’organisme doit libérer plus d’insuline que d’accoutumer pour contrôler la glycémie.
Avec le temps, ces souris sont par contre devenues incapables de sécréter de l’insuline et donc de contrôler la quantité de glucose présente dans le sang.
Ces données suggèrent qu’un transport altéré de la leptine vers le cerveau, via ces récepteurs LepR,
est impliqué dans le développement du diabète de type 2, comme le précise le communiqué de l’Inserm. Au final, tout se passe donc un peu comme si, chez l’animal privé de récepteur LepR,
la glycémie à jeun et aussi après injection de glucose s'élevait anormalement, le pancréas devenant incapable de secréter de l’insuline en raison du non-message reçu par le cerveau.
La preuve a d'ailleurs été apportée par la seconde étape des travaux des chercheurs qui ont ensuite procédé à la réintroduction de la leptine dans le cerveau des rongeurs.
Résultat : un retour à la normale côté sécrétion d’insuline par le pancréas, les souris retrouvant rapidement un métabolisme normal.
Une pathologie du système nerveux central
"Nous démontrons d’une part que la perception de la leptine par le cerveau est indispensable pour la gestion de l’homéostasie énergétique et de la glycémie.
D’autre part, que le blocage du transport de la leptine vers le cerveau altère le bon fonctionnement des neurones qui contrôlent les sécrétions d’insuline du pancréas", conclut Vincent Prévot, directeur de recherche à l’Inserm.
Pour les chercheurs, ce travail met l'accent sur le rôle du cerveau dans le diabète, ce qui amène à considérer cette pathologie aussi comme une maladie du système nerveux central.
À noter un autre résultat apporté par cette étude : le modèle de souris obtenu par retrait du récepteur LepR correspond à ce que les chercheurs appellent le "diabète est asiatique", encore peu étudié.
Un phénotype prédominant, comme son nom l’indique, en Asie (surtout en Corée et au Japon) et distinct du "diabète occidental", où le surpoids est lui plus marqué, avec même souvent une obésité morbide.
Et les chercheurs de voir en l’obtention de ce nouveau modèle un outil supplémentaire susceptible de faire avancer la recherche sur une pathologie, le diabète de type 2, qui concerne aujourd’hui plus de 350 millions de personnes dans le monde.